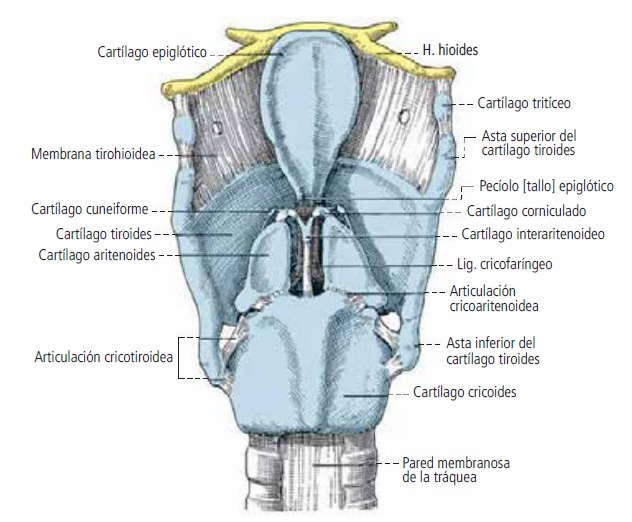
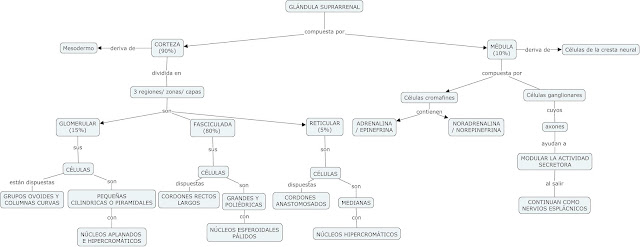
1. Analice los resultados de cada uno de los tubos de ensayo del experimento vía physioex
Tubo Nº 1:
En el primer tubo, tenemos amilasa y almidón a un pH de 7, sin embargo, el tratamiento consiste en llevarlos a punto de ebullición (hervido), esto causa que la enzima se desnaturalice y no pueda llevar a cabo la hidrolisis del almidón, esto se comprueba debido a que el reactivo IKI da positivo, indicando presencia de almidón, sin embargo, al no poder llevar la hidrolisis, no es posible encontrar azucares reductores como Maltosa, razón por la cual la prueba con el reactivo Benedict da un resultado negativo.
Tubo Nº 2:
En el segundo tubo, tenemos lo mismo que el primer tubo, lo que cambia es el tratamiento, debido a que ahora se congelara el tubo de ensayo, sin embargo, el resultado negativo para la prueba con IKI indica que si se llevó a cabo la hidrolisis del almidón y el reactivo Benedict con el resultado positivo confirma esto. Esto nos lleva a concluir que el congelamiento no supone alteración en la estructura de la enzima y que luego de llevarse a temperatura de 37ºC, la enzima recupera su facultad para hidrolizar al almidón.
Tubo Nº 3:
En este tubo, tenemos lo mismo que en los 2 anteriores, sin embargo, aquí no se ha sometido a ningún tratamiento de ebullición o congelamiento, así que con el pH optimo y la temperatura de 37 ºC, la amilasa trabaja adecuadamente dando de esta manera un resultado negativo para la prueba con IKI y uno positivo con el reactivo de Benedict. Para los resultados positivos con Benedict, cabe recalcar que, tras una reacción entre el grupo reductor del azúcar y el sulfato cúprico del reactivo de Benedict, se observa una precipitación del compuesto denominado oxido cuproso de color rojo ladrillo y varia de tonalidad dependiendo la cantidad de azucares reductores en la muestra.
Tubo Nº 4:
En el tubo 4 encontramos amilasa y agua desionizada, pero no hay almidón, por tanto, no hay sustrato para la amilasa, razón por la cual no habrá productos que arrojen un resultado positivo para Benedict. Esto se comprueba debido a que al no haber almidón la prueba con IKI arroja un resultado negativo, y como se mencionó arriba tampoco habrá azucares reductores, lo cual representa un resultado negativo para la prueba con el reactivo de Benedict. Este tubo 4 representa a su vez nuestro control negativo para ambos reactivos.
Tubo Nº 5:
En el tubo 5 hay agua desionizada y almidón, pero no hay amilasa que catalice la hidrolisis del almidón, razón por la cual esperamos que la prueba con Benedict nos dé un resultado negativo. En efecto, al no haber amilasa el almidón se mantiene igual, dando un resultado positivo para IKI, y como se suponía el resultado para Benedict será negativo. Esto a su vez nos indica que el experimento se está realizando bien y no existen azucares reductores que estén contaminando nuestra muestra.
Tubo Nº 6:
A comparación del tubo anterior, este tubo contiene maltosa en lugar de almidón, por lo que es de esperarse que sea negativo para IKI y positivo para Benedict. La razón por que la es negativo para IKI es porque no hay almidón en nuestro tubo de ensayo, mientras que el carácter reductor de la maltosa nos conduce a un resultado positivo para la prueba con Benedict. Esto también comprueba que, en nuestro tubo de ensayo, no existe almidón que este contaminando nuestra muestra.
Tubo Nº 7:
En el tubo 7, existen los mismos componentes que en los 3 primeros tubos, sin embargo, cambia el pH, ya que aquí tiene un valor de 2. Este cambio del pH supone que la enzima no catalice la reacción como lo haría a su pH optimo, razón por la cual el almidón no es catalizado totalmente y arroja resultados positivos para IKI. Para el caso de la prueba con el reactivo de Benedict, podemos apreciar un positivo parcial (+), debido a que como no todo el almidón ha sido hidrolizado encontraremos menor cantidad de azucares reductores que en los tubos 2 y 3 donde la enzima funciona a un pH óptimo.
Tubo Nº 8:
En el tubo 8, existen los mismos componentes que en los 3 primeros tubos y en el séptimo, sin embargo, cambia el pH, ya que aquí tiene un valor de 9. Este cambio del pH supone que la enzima no catalice la reacción como lo haría a su pH optimo, razón por la cual el almidón no es catalizado totalmente y arroja resultados positivos para IKI. Para el caso de la prueba con el reactivo de Benedict, podemos apreciar un positivo parcial (+), debido a que como no todo el almidón ha sido hidrolizado encontraremos menor cantidad de azucares reductores que en los tubos 2 y 3 donde la enzima funciona a un pH óptimo.